
CRISPR-Cas sistemos yra vienas iš bakterijų ir archėjų būdų apsisaugoti nuo virusų. Skirtingos bakterijos gali turėti kelių tipų apsaugines CRISPR-Cas sistemas, kurios skiriasi Cas baltymais ir jų funkcijomis. Šiuo metu plačiausiai tiek pasaulyje, tiek Lietuvoje yra žinomas bakterijų apsaugos nuo virusų Cas9 baltymas.
Tačiau neseniai Vilniaus universiteto Gyvybės mokslų centro Biotechnologijos instituto mokslininkų atliktus CRISPR-Cas mechanizmo tyrinėjimus vainikavo naujas atradimas. Baltymų–nukleorūgščių sąveikos tyrimų skyriaus komanda atskleidė, kad bakterijų apsaugos nuo virusų CRISPR-Cas10 sistemos, atpažinusios į ląstelę patekusias svetimas viruso nukleorūgštis, sintetina unikalias signalines molekules (ciklinius oligoadenilatus). Atrastos molekulės yra unikalios, nes apie jų egzistavimą gamtoje iki šiol nebuvo žinoma. Šis Vilniaus universiteto mokslininkų atradimas buvo paskelbtas prestižiniame mokslo žurnale „Science“.
Kodėl mums rūpi bakterijų ir virusų kova?
Bakterijos ir virusai mums visų pirma asocijuojasi su ligomis. Iš tiesų, prieš atrandant antibiotikus, bakterinės infekcijos – plaučių uždegimas, tuberkuliozė, sepsis, cholera, dizenterija – buvo pagrindinė žmonių mirties priežastis. Dabar bakterijos mums padeda valyti išsiliejusią naftą, naikinti atliekas, gaminti fermentuotus pieno produktus, biodegalus, antibiotikus, diagnostinius ir žmogaus terapijai skirtus baltymus. Žmogaus organizme egzistuoja keli šimtai skirtingų bakterijų rūšių ir šie mikroorganizmai nėra žmogaus priešai – jie sudedamoji mūsų kūno dalis. Kiekvieno žmogaus organizme bakterijos padeda virškinti maistą, pasigaminti reikiamų vitaminų, kovoti su kitomis – žalingomis bakterijomis. Su mūsų organizme gyvenančiomis bakterijomis mokslininkai sieja polinkį į alergijas, bakterijos gali lemti nutukimą, susirgimą kai kuriomis ligomis (pvz., diabetu), taip pat organizmo reakciją į kai kuriuos vaistus. Sutrikusi bakterijų pusiausvyra gali paspartinti, pasunkinti autoimunines ligas (pvz., išsėtinę sklerozę).
Neseniai mokslininkai aptiko, kad nuo mūsų žarnyne gyvenančių bakterijų priklauso organizmo galimybė apsiginti nuo vėžio. Audinių mėginiai parodė, kad žmonės, turintys naudingųjų bakterijų, turėdavo ir daugiau vėžį žudančių imuninių ląstelių.
Bakterijas, kaip ir žmones, nuolat atakuoja bakteriofagai – bakterijų virusai. Žmogaus susidūrimas su virusais dažniausiai baigiasi pagydomu susirgimu, o bakterijai – ląstelės žūtimi. Siekdamos išgyventi tokioje aplinkoje, bakterijos evoliucijos metu sukūrė ir nuolat kuria įvairius apsaugos mechanizmus, padedančius išvengti bakteriofagų infekcijos. Restrikcija-modifikacija, CRISPR-Cas, BREX, DISARM – šiuo metu mokslininkams žinomos bakterijų apsaugos nuo virusų sistemos.
Spėjama, kad gamtoje egzistuoja apie 30 dar neatrastų sistemų.
Proveržis genų inžinerijoje
Makromolekules, kurias bakterijos sukūrė savo apsaugai, žmonės gali panaudoti savo reikmėms. Puikus to pavyzdys galėtų būti bakterijų apsaugos baltymų – restrikcijos endonukleazių, arba restrikcijos fermentų – atradimas, kuris 1978 m. buvo įvertintas Nobelio premija. Ją gavo Šveicarijos mokslininkas Werneris Arberis ir JAV mokslininkai Danielis Nathansas ir Hamiltonas Smithas. Jie susidomėjo šiais fermentais pastebėję unikalią jų savybę – gebėjimą atpažinti tam tikrą DNR seką ir tiksliai toje vietoje ją perkirpti.
Mokslininkams atsirado galimybė panaudoti natūralias mikroskopines DNR „žirkles“ – restrikcijos fermentus, panašiai kaip sodininkas naudojasi žirklėmis, skiepydamas medžius. Šie fermentai tapo pagrindiniu genų inžinerijos molekuliniu instrumentu manipuliuojant DNR sekomis visose mokslinėse laboratorijose ir biotechnologijos pramonėje.
CRISPR-Cas sistema – primityvus bakterijų imunitetas
Dar 1987 m. Escherichia coli bakterijų genome buvo atrastos pasikartojančios DNR sekos su viruso DNR fragmentais. Paaiškėjo, kad jų išsidėstymas nėra atsitiktinis – virusinės DNR gabaliukai sudėlioti pakaitomis su bakterine DNR, tarsi karoliai iš skirtingo dydžio karoliukų. Dėl to sistema taip ir pavadinta – taisyklingai pertraukti trumpi susitelkę pasikartojimai (angl. Clustered regularly interspaced short palindromic repeats). Kiekvienas viruso DNR fragmentas yra skirtingas – jis gautas iš skirtingų bakteriją infekavusių virusų. Taip bakterija sukaupia informaciją apie ją atakavusius virusus ir ją saugo tam tikroje savo genomo vietoje tarytum įrašus kartotekoje. Vėliau, tam pačiam virusui nusitaikius į bakteriją antrą kartą, ši informacija panaudojama virusui sunaikinti ir bakterijai apsaugoti. Galima sakyti, kad CRISPR-Cas sistema yra primityvus įgytas bakterijų imunitetas, nes su kiekviena viruso ataka įgyjamas naujas atsparumas užpuolikui. Kai virusas bando antrą kartą užvaldyti bakteriją, ląstelėje pasigamina molekulės, dar vadinamos crRNR (angl. CRISPR RNR), kurios susijungia su Cas baltymais (angl. CRISPR associated). Susidariusios biologinės molekulės atpažįsta sekas virusinėje DNR ir ją perkerpa. Taip virusas yra inaktyvuojamas nepadaręs bakterijai žalos.
Cas9 – „blogiems“ genams taisyti
Cas9 galime vadinti antros kartos DNR molekulinėmis žirklėmis. Pasirodo, galima nesunkiai pakeisti Cas9 surištą crRNR molekulę ir kartu Cas9 atpažįstamą DNR seką. Šią Cas9 savybę mokslininkai pavadino programuojamu kirpimu – panaudojant skirtingą crRNR molekulę, galima užprogramuoti Cas9 kirpti DNR bet kurioje norimoje vietoje. Tokios programuojamos DNR žirklės veikia ne tik bakterijose, bet ir mėgintuvėlyje. Dar daugiau, Cas9 molekulines žirkles galima panaudoti ir visuose gyvuose organizmuose – mielėse, grybuose, augaluose, žuvų, žinduolių ląstelėse. Naudojant antros kartos molekulines žirkles tikimasi įgyvendinti seną mokslininkų svajonę – Cas9 baltymą pritaikyti „blogiems“ genams taisyti ir žmonių genetinėms ligoms gydyti.
Šis mechanizmas labai tinka gydyti paveldimoms ligoms – toms, kurios atsiranda dėl esamų klaidų genominėje DNR. Tai pjautuvinė anemija, hemofilija A, plaučių vėžys, cistinė fibrozė, Hantingtono liga ir kitos. Toks DNR sekos pakeitimas pasižymi visišku tikslinio baltymo panaikinimu ląstelėje: ištrynus reikiamą „taisyklę“ genominėje DNR, ląstelė nebežino, kaip pagaminti atitinkamą baltymą. Tiesa, tai mokslo bendruomenėje kelia vertybines diskusijas, ar iš principo yra etiška genetiškai modifikuoti žmogų.
CRISPR-Cas10 – RNR molekulinės žirklės baltymų funkcijoms išaiškinti
Mūsų mokslininkų komandos tyrinėjamos CRISPR-Cas10 bakterijų apsaugos sistemos yra kur kas sudėtingesnės už Cas9 ir pasižymi net keliais skirtingais aktyvumais. Cas10 kartu su keletu pagalbinių baltymų, panašiai kaip ir Cas9, sudaro kompleksą su trumpa crRNR. Šis biologinis kompleksas bakterijos ląstelėje dalyvauja sunaikinant virusą. Virusui užpuolus bakteriją, CRISPR-Cas10 ne tik sunaikina viruso DNR kaip Cas9, bet kartu sukarpo ir jau pradėtas sintetinti viruso molekules tarpininkes – RNR. Taip bakterija užsitikrina, kad sunaikino ne tik viruso „taisyklių“ rinkinį, bet ir visas nurašytas jo kopijas, kuriomis virusas galėtų pasigaminti savo baltymų, pragaištingų bakterijai.
Panašiai kaip DNR kirpimui Cas9, CRISPR-Cas10 RNR molekulines žirkles galima suprogramuoti kirpti RNR bet kurioje norimoje vietoje. Naudojant mūsų atrastas RNR molekulines žirkles būtų galima patikrinti, kas organizme nutinka pašalinus vieną ar kitą jų ląstelių RNR, nešančią informaciją apie tam tikro baltymo gamybą. Taip galėtume sužinoti, kurie konkrečiai baltymai yra svarbūs įvairiems ląstelės procesams: vystymuisi ar senėjimui, infekcijai ar vėžėjimui. Remdamiesi šiais tyrimais mokslininkai galėtų atsirinkti šiuos baltymus detaliems tyrimams, kad būtų surasti vaistai, veikiantys pasirinktus procesus, pvz., vėžio ar Parkinsono ligos vystymąsi. Išmokus įterpti CRISPR-Cas10 RNR molekulines žirkles į žmogaus ląsteles, būtų galima jas tiesiogiai panaudoti žmogui pavojingiems RNR virusams – hepatito C, Ebolos, AIDS, poliomielito ar tymų – sunaikinti.
Gydant kai kurias ligas gali būti svarbu kokio nors baltymo atsisakyti tik laikinai, o paskui jį vėl sugrąžinti. Tokiu atveju labai tinka būtent CRISPR-Cas10 RNR molekulinės žirklės, nes jas naudojant yra panaikinama didžioji dalis RNR, nešančios informaciją apie tą baltymą. Kadangi šio gydymo metu ląstelės DNR išlieka nepakitusi, prireikus vėliau galima „įjungti“ tikslinio baltymo sintezę ląstelėje tiesiog atnaujinus RNR sintezę. Tai ypač aktualu gydant įvairius vėžinius susirgimus. Tad nors Cas9 ir CRISPR-Cas10 technologijų taikymas galimas artimose srityse, abu šie metodai turi savo paskirtis. Tiesa, taikant CRISPR-Cas10 technologiją intervencija į ląstelę yra švelnesnė, grįžtamoji, jos metu nekeičiama genetinė medžiaga, todėl gali kilti mažiau etinių jos pritaikymo problemų. Šiuo metu mūsų komanda tyrinėja galimybes pritaikyti CRISPR-Cas10 RNR molekulines žirkles modeliniuose organizmuose, pvz., žuvytėje vardu zebrinė danija (Danio rerio) ir žmogaus vėžinėse ląstelėse.
Bakterijos, kurios savo gynybai naudoja CRISPR-Cas10 mechanizmą, pasirodo, savo arsenale turi unikalų ginklą – dar vieną CRISPR-Cas10 aktyvumą. Visai neseniai atradome, kad, virusui užpuolus bakteriją, CRISPR-Cas10 apsaugos sistema ne tik sunaikina viruso DNR ir RNR, bet tuo pat metu ir susintetina unikalias signalines molekules.
Signalinės molekulės atlieka bakterijų gelbėjimo misiją
Signalinių molekulių atradimas rodo, kad bakterijos saugo savo giminę nuo išnykimo naudodamos net ir pačius drastiškiausius būdus – susinaikinimą, kad išgyventų kaimyninės bakterijos.
Vos tik prasiveržęs į bakterijos ląstelę, virusas ją priverčia dalytis pagal savo „taisykles“ ir taip siekia padauginti save – savo DNR, tarpines molekules RNR ir sau reikalingus baltymus. CRISPR-Cas10 bakterijų apsaugos sistema, atpažinusi į ląstelę patekusį virusinės kilmės taikinį, iš karto reaguoja. Ji padeda bakterijai gintis naikindama viruso DNR ir RNR. Kartu CRISPR-Cas10 sintetina ir signalines molekules – ciklinius oligoadenilatus. Kartais gali nutikti taip, kad matydama, jog pralaimi kovą su virusu, bakterija griebiasi paskutinio šiaudo. Susintetintos signalinės molekulės signalizuoja ląstelei „įjungti“ susinaikinimo mechanizmą. Šios molekulės bakterijoje aktyvuoja pagalbines RNR žirkles – visą ląstelės RNR degraduojantį baltymą Csm6. Ciklinio adenilato molekule aktyvuotas Csm6 baltymas degraduoja ne tik viruso RNR, bet ir visos ląstelės RNR. Bakterijos ląstelė žūva, tačiau ir virusas nebegali pasidauginti, lieka uždarytas ląstelės viduje ir todėl negali užpulti šalia esančių bakterijų. Taip altruistiškai pasiaukojus vienai virusu užkrėstai ląstelei, bakterijų kolonija lieka išgelbėta.
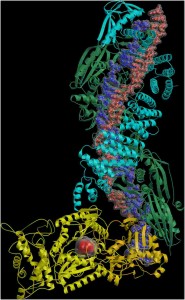
CRISPR-Cas10-crRNR kompleksas, surišęs taikinio RNR molekulę ir ATP molekulę, iš kurios kompleksas sintetina ciklines signalines molekules. Modelį sukonstravo Česlovas Venclovas, paveikslą paruošė Giedrė Tamulaitienė
Visi CRISPR-Cas10 sistemos aktyvumai bakterijoje yra griežtai reguliuojami, kad nepakenktų pačiai bakterijai „taikos“ sąlygomis. CRISPR-Cas10 komplekso RNR molekulinės žirklės yra tarytum šios apsaugos sistemos laikmatis, kuris užtikrina, kad visi CRISPR-Cas10 gynybiniai aktyvumai veiktų sklandžiai.
Mūsų atradimas yra įdomus biologijos mokslui, nes jo žinias papildėme naujo tipo signalinėmis molekulėmis. Žinoma, kad įvairios signalinės molekulės reguliuoja įvairius procesus bakterijos viduje. Ateityje bus įdomu sužinoti, ar ciklinių adenilatų molekulės tarnauja signalinėmis molekulėmis bakterijoms bendraujant tarpusavyje. Į Csm6 panašių baltymų rūšių bakterijose yra ir daugiau – deoksiribonukleazių, transkripcijos veiksnių. Be to, ne visi jie egzistuoja kartu su CRISPR-Cas sistemomis. Todėl gali būti, kad šis signalinis kelias būdingas ne tik CRISPR-Cas sistemoms, bet yra kur kas plačiau naudojamas ir kituose mikroorganizmuose.
Padės gydant pavojingas bakterines ligas
Ciklinių molekulių atradimas mokslininkams atvers daug galimybių įvairiose srityse. Visų pirma, CRISPR-Cas10 sistemą galima pritaikyti gaminant molekulinius įrankius moksliniams tyrimams. Mūsų atrasti baltymai geba efektyviai naikinti RNR ir šį aktyvumą įmanoma kontroliuoti. Vadinasi, Csm6 baltymo aktyvumą galima „įjungti“ arba „išjungti“ kada tik reikia. Tai leidžia Csm6 panaudoti kaip aktyvuojamą RNR degraduojantį baltymą arba jo pagrindu sukurti kitokius aktyvumus turinčius reguliuojamus baltymus.
Atrastos signalinės molekulės gali padėti sunaikinti bakterijas, kurios žmogaus organizme sukelia sunkias ar mirtinas ligas. Kai kurios patogeninės bakterijos, pvz., Mycobacterium tuberculosis, žmogui sukeliančios tuberkuliozę, koduoja CRISPR-Cas10 sistemas ir Csm6 baltymą. Jeigu tokiose bakterijose imituotume viruso puolimą, jos pradėtų sintetintis signalines molekules ir susinaikintų. Alternatyvus kelias – cheminėje laboratorijoje susintetinti ciklinius oligoadenilatus ir panaudoti juos kaip antibiotikus. Šioms ciklinėmis molekulėms prasiskverbus į patogenines bakterijas ir aktyvavus Csm6 baltymą, būtų galima sukelti savaiminę bakterijų mirtį. Tuo atveju mūsų atrastos ciklinės molekulės galėtų tapti vaistais gydant žmogų nuo tuberkuliozės ir kitų pavojingų bakterinių ligų.


















Komentarų nėra. Būk pirmas!