„Eukariotinės ląstelės yra maži, bet kompleksiški, save reguliuoti gebantys vienaląsčiai organizmai, kurie gali būti ir daugialąsčių organizmų sudedamoji dalis“, − teigia Vilniaus universiteto (VU) Biomokslų instituto Biochemijos ir molekulinės biologijos katedros jaunesnioji mokslo darbuotoja Vilmantė Žitkutė.
V. Žitkutė kartu su kolegomis vykdo VU mokslo skatinimo fondo jaunųjų mokslininkų projektą „CRISPR-Cas13 technologijos taikymas tiriant atsparumą chemoterapiniams vaistams“. Šio projekto metu siekiama išbandyti CRISPR-Cas13 technologiją, kuri kol kas nėra plačiai taikoma moksliniams tyrimams su žinduolių ląstelėmis, ir tikimasi ateityje ją pritaikyti atsparumo chemoterapiniams vaistams priežasčių paieškai.
Atviri tarpdisciplininiam bendradarbiavimui
V. Žitkutė pabrėžia, kad jos ir laboratorijos kolegų vystomos temos yra įvairios ir jie yra atviri bendradarbiavimui su kitų sričių mokslininkais. Šiuo metu jų laboratorija bendradarbiauja su medikais, mikrobiologais ir kitų sričių atstovais, kartu su medicinos genetikais tiria retas genetines ligas ir ieško jų priežasčių. Daug žadančių rezultatų pateikė ir projektas, vykdytas su mikrobiologais iš VU Biochemijos instituto Molekulinės mikrobiologijos ir biotechnologijos skyriaus.
„Šio skyriaus mokslininkai tiria bakteriofagų – virusų, užkrečiančių bakterijas, baltymų taikymą nanomedicinoje. Vienas iš tokių baltymų yra bakteriofagų kapsidės baltymas. Šis baltymas savaime susirenka į nanovamzdelius. Tad mūsų užduotis buvo ištirti, ar tie nanovamzdeliai gali patekti į vėžines ląsteles. Mes nustatėme, kad jie patenka ir nėra toksiški ląstelėms. Tad, atlikus dar daugiau tyrimų, išsiaiškinus jų poveikį organizmui, galbūt šie nanovamzdeliai ateityje galės būti pritaikyti vaistų pernašai žmogaus organizme. Labai džiaugiamės tokiais projekto rezultatais ir tikimės, kad jie prisidės prie ateities mokslinių tyrimų“, − rezultatais dalijasi tyrėja.
Žinduolių ląstelės – maži, bet sudėtingi gyvų organizmų struktūriniai vienetai
V. Žitkutė pažymi, kad kiekviena žmogaus ląstelė yra tarsi atskiras elementas, jautrus pokyčiams, įvykusiems jos viduje arba išorėje, ir gebantis prie šių pokyčių prisitaikyti keičiant molekulinius procesus.
„Pavienė ląstelė reguliuoja savo dalijimąsi, signalinių molekulių raišką, palaiko homeostazę, reaguoja į patiriamą stresą, pavyzdžiui, deguonies ar maisto medžiagų trūkumą, į jų vidų patekusius patogenus, tokius kaip bakterijos ar virusai, galiausiai gali nuspręsti, kad jai laikas susinaikinti, t. y. aktyvinti programuotą ląstelių žūtį. Be to, dėl signalinių molekulių ląstelės organizme geba „bendrauti“ ir tarpusavyje. Taip pat ląstelės gali reaguoti ir į vaistus bei išvengti jų poveikio“, – molekulinius procesus pristato mokslininkė.
Vėžines ląsteles nuolat veikiant vaistu ir pamažu didinant jo koncentraciją, galima įžvelgti procesą, iš dalies panašų į evoliuciją. Jei ląstelė išvengia vaisto poveikio, o kitos to paties tipo ląstelės žūsta, vadinasi, šios ląstelės yra atsparesnės vaisto poveikiui nei kitos.
„Tokios ląstelės toliau dalijasi ir taip atsiranda daugiau atsparių ląstelių. Ląstelė, prisitaikydama prie vaisto poveikio, keičia įvairius molekulinius mechanizmus reguliuodama tam tikrų molekulių raišką. Pavyzdžiui, ląstelė turi specialius nešiklius, kurie perneša vaistą į ląstelę, tad ji gali sumažinti šių nešiklių kiekį ir taip užkirsti kelią vaisto patekimui“, − vieną iš ląstelės savisaugos būdų paaiškina mokslininkė.
V. Žitkutės moksliniuose tyrimuose naudojami chemoterapiniai vaistai 5-fluoruracilas ir oksaliplatina sukelia pažaidas DNR molekulėje ir vienas iš atsparumo mechanizmų yra aktyvinti molekulinius procesus, kurie yra atsakingi už šių pažaidų ištaisymą. Vienas iš procesų, kuriuos tiria mokslininkė, yra autofagija.
„Mėgstu sakyti, kad autofagija yra tarsi ląstelės skrandis. Jeigu ląstelė patiria stresą, pavyzdžiui, jai trūksta maisto, yra pažeidžiamos organelės ar ląstelėje kaupiasi netinkamai susilankstę baltymai, ląstelė aktyvuoja autofagiją. Autofagijos metu ląstelėje susidaro dvigubą membraną turinčios pūslelės, kurios apgaubia pažeistas molekules ar organeles ir jas nukreipia į lizosomas. Lizosomose esantys fermentai suskaido autofagosomų turinį, o skaidymo produktai yra panaudojami naujų molekulių ar organelių gamybai. Tokiu būdu ląstelė gali išvengti ir neigiamo vaistų poveikio“, − pasakoja V. Žitkutė.
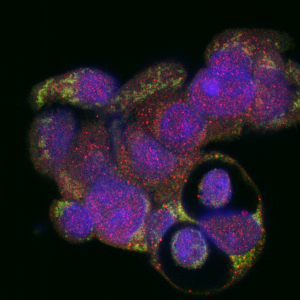
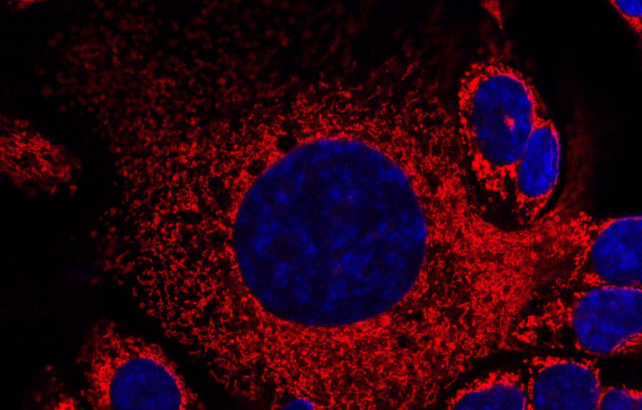
Keistos formos ląstelės. Mėlyna – branduoliai, o žalia ir raudona – tiriami baltymai, organelės.
Mokslininkė pripažįsta, kad ląstelių tyrimai yra labai apsunkinti, nes tyrimo metu ląstelių linija yra atskiriama nuo aplinkos, taigi nutolstama nuo realių sąlygų žmogaus organizme.
„Taip pat svarbu atsižvelgti ir į tai, kad vėžinės ląstelės audinyje yra veikiamos įvairių faktorių: kraujotakos, imuninių ląstelių ir kitų tipų ląstelių. Aišku, viskas tobulėja ir dabar jau vis dažniau vykdome tyrimus, kur ląstelės auga ne tik Petri lėkštutėje, bet ir sudaro 3D struktūras – sferoidus, kuriuose ryšiai tarp ląstelių yra sudėtingesni ir labiau primena susidariusį naviką. Taip vis artėjame prie realesnių sąlygų“, − teigia V. Žitkutė.
Atsparumas vaistams dažniausiai yra įgyjamas gydymo metu
Žmogus suserga vėžiu, nes ląstelių DNR molekulėje įvyksta mutacijos, dėl kurių sutrinka procesai, lemiantys normalų ląstelių funkcionavimą. Dėl įvykusių mutacijų ląstelėse gali būti aktyvinami išgyvenimo signalai, kurie lemia nevaldomą jų dalijimąsi. Ląstelės gali išvengti žūties sutrikus programuotą ląstelių žūtį reguliuojančių baltymų raiškai. Šios priežastys ir lemia naviko susidarymą. V. Žitkutė pasakoja, kad tam tikrais atvejais tokie pokyčiai navikinėse ląstelėse gali lemti ir atsparumą chemoterapiniams vaistams, nors dažniausiai atsparumas išsivysto gydymo metu.
„Žmogaus ląstelės yra labai skirtingos ir nevienodai reaguoja į stresą. Jei vėžiu sergantis žmogus yra gydomas vaistais ir didžioji dalis naviko ląstelių žūsta, tai dar nereiškia, kad liga yra įveikta. Jei po gydymo lieka nors kelios ląstelės, kurios yra atsparios šiems vaistams, nutraukus gydymą jos gali pradėti dalytis ir tapti dar agresyvesnės, nei buvo anksčiau“, − pasakoja mokslininkė.
Laboratorijoje, kurioje dirba V. Žitkutė, iš kelių žmogaus kolorektalinio vėžio ląstelių linijų yra išvestos sublinijos, kurios yra atsparios chemoterapiniams vaistams 5-fluoruracilui ir oksaliplatinai, Mokslininkai tiria šių vaistų atsparumo mechanizmus.
„Kolorektaliniam vėžiui gydyti yra naudojama šių vaistų kombinacija, kad būtų sustiprintas jų veikimas. Mūsų mokslinių tyrimų rezultatai parodė, kad dažniausiai ląstelių sublinija, kultivuota tik su vienu vaistu, įgyja atsparumą tik šiam vaistui. Tačiau esame išvedę ląsteles, kurios buvo veiktos tik su oksaliplatina, o įgijo atsparumą ne tik šiam vaistui, bet ir kitiems vaistams, tarp jų ir 5-fluoruracilui. Tad šias ląsteles paveikus kitais vaistais jos nežūsta. Abu šie vaistai padaro pažaidas ląstelės DNR, bet mus nustebino, kad atsparumą šie preparatai sukuria labai skirtingą“, − atskleidžia V. Žitkutė.
Ieškoma būdų, kaip sumažinti baltymų kiekį ląstelėje
Ląstelėje labai svarbų vaidmenį atlieka įvairios baltymų grupės. Dalis ląstelės baltymų yra skirti jos žūčiai, tad sumažindama šių baltymų kiekį ląstelė išvengia žūties. O kiti baltymai aktyvina signalus, padedančius ląstelei išgyventi, tad siekdama išlikti ląstelė šių baltymų kiekį padidina. Vykdydami projektą „CRISPR-Cas13 technologijos taikymas tiriant atsparumą chemoterapiniams vaistams“ mokslininkai siekia surasti būdą, kaip, mažinant transkripto (DNR nuorašo) kiekį, kartu sumažinti ir pasirinkto baltymo kiekį ląstelėje.
V. Žitkutė su kolegomis taiko CRISPR-Cas 13 technologiją, kuri skirta į bakteriją patekusiems virusams nugalėti. Jos tikslas toks pat kaip ir CRISPR-Cas 9 technologijos – sunaikinti į ląstelę patekusį virusą, bet mechanizmas yra kitoks.
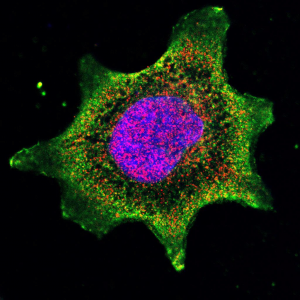
HCT116/FU ląstelės, atsparios 5-fluoruracilo poveikiui. Mėlyna – branduolys, žalia ir raudona – du skirtingi baltymai.
„Ląstelėje esančioje DNR molekulėje yra užkoduotos baltymus koduojančios sekos ir kiti komponentai, reikalingi ląstelei funkcionuoti. Informacija apie baltymus, esančius DNR molekulėje, pirmiausia yra nurašoma į RNR molekules, kurios yra vadinamos transkriptais. Transkriptai, kurie susidaro ląstelės branduolyje, keliauja į ląstelės citoplazmą, kur pagal jo seką yra pagaminami baltymai. CRISPR-Cas 9 technologija iš genomo iškerpa tam tikrą geną, o CRISPR-Cas 13 kerpa ne pačią DNR, o nuo jos padarytą nuorašą – transkriptą. Tad vienas didžiausių CRISPR-Cas 13 pranašumų yra tas, kad ši technologija nekeičia genų ir negali pažeisti ląstelės genomo“, − skirtumą įvardija mokslininkė.
Pirmieji straipsniai apie CRISPR-Cas 13 technologiją ir jų pritaikymą eksperimentams su žinduolių ląstelėmis pasirodė tik 2016 m., tad ši technologija dar nauja ir reikalinga daugybės tyrimų. V. Žitkutė pažymi, kad vienas iš šios technologijos trūkumų yra jos toksiškumas ląstelėms.
„Bandydami transfekcijos metu „pernešti“ CRISPR-Cas 13 kompleksus į ląsteles pastebėjome, kad šie gali būti toksiški ir sukelti ląstelių žūtį. Tad dabar ieškome sąlygų, kuriomis ši technologija ne tik sumažintų mūsų tiriamų baltymų kiekį, bet ir nebūtų toksiška ląstelėms“, − pasakoja V. Žitkutė.
Vykdomo projekto metu V. Žitkutė su kolegomis siekia 100 proc. sumažinti pasirinkto baltymo kiekį, kas leistų pradėti funkcinius tyrimus ląstelėje ir išsiaiškinti, ar konkretus tiriamas baltymas yra ląstelei gyvybiškai svarbus.
„Jeigu sumažinus baltymo kiekį ląstelės žūsta, tai reiškia, kad pasirinktas baltymas yra svarbus ląstelių išgyvenimui. O jeigu chemoterapiniams vaistams atspariose ląstelėse sumažinus pasirinkto baltymo kiekį ląstelės tampa jautresnės vaisto poveikiui, vadinasi, tas baltymas galbūt yra svarbus ir ląstelių atsparumui“, − pasakoja mokslininkė.
Nuo pirminių ląstelių prie organoidų ir kompiuterinių sistemų
V. Žitkutė džiaugiasi, kad per pastaruosius 70 metų ląstelės biochemijos sritis smarkiai patobulėjo ir dabar laboratorijoje jau galima užauginti ne tik pirmines ar vėžines ląsteles, bet ir erdvines ląstelių struktūras bei organoidus.
„Labai tikiuosi, kad ateityje reikės vis mažiau laboratorinių tyrimų su gyvūnais ir vis mažiau darbų bus atliekama Petri lėkštelėse. Taip pat viliuosi, kad dabar naudojami sudėtingi procesai taps paprastesni, pigesni ir labiau prieinami kiekvienai laboratorijai ir taip mes galėsime priartėti prie žmogaus neliesdami paties žmogaus“, − teigia mokslininkė.
Kaip vieną iš ateities proveržio sričių mokslininkė įvardija organus ant lustų. Tai mažos sistemos, kurias sudaro skirtingi skyriai, turintys skirtingas ląstelių grupes, iš dalies atkartojančias tam tikrą organą, pavyzdžiui, plaučius ar širdį.
„Šiose sistemose sukeliami net širdies ląstelių susitraukimai, o plaučių sistemoje cirkuliuoja oras. Šiuo atveju jau galime nagrinėti ne vieną ląstelių liniją, o dalį organo. Tad galima įdėti vaisto ir stebėti, kaip reaguoja ne tik pavienės ląstelių linijos, o ir kiti luste esantys iš skirtingų ląstelių sudaryti organoidai. Bet šis metodas dar labai brangus ir sudėtingas“, – sako V. Žitkutė.
Ne mažiau pažangus metodas – virtualios sistemos. Kaip vieną iš tokių pavyzdžių mokslininkė pateikia duomenų bazę, kurioje sudėta visa įmanoma informacija apie pasirinktą bakteriją: jos genomas, metabolizmas, dalijimosi greitis ir t. t.
„Turint tokią išsamią duomenų bazę kompiuteryje, galima ištrinti pasirinktą geną ir stebėti, kaip tai paveiks ląstelę. Ištrynus pasirinktą geną, kompiuteryje yra paleidžiamas ląstelės ciklas, t. y. virtualiai ląstelei yra duodamas startas pradėti dalytis. Ląstelei pasidalijus yra nustatoma, kokius pokyčius lėmė ištrintas genas. Jei šis pokytis yra reikšmingas, tokį eksperimentą būtų galima kartoti Petri lėkštutėje“, – teigia tyrėja.
Tokios sistemos mokslininkams leistų sutaupyti ne tik laiko, bet ir reagentų, kurie kainuoja nemažai. Tačiau virtualių sistemų naudojimo procesas yra labai sudėtingas, jam reikia galingų kompiuterių ir milžiniško atminties kiekio duomenims saugoti.
„Aš labai tikiuosi, kad ateityje, tobulėjant technologijoms, galėsime vykdyti tyrimus ne tik su organais ant lustų, bet ir pasitelkdami kompiuterines sistemas“, − sako V. Žitkutė.


















Komentarų nėra. Būk pirmas!