
Geriausiu ir prestižiškiausiu pasaulyje pripažįstamame mokslo žurnale „Science“ buvo publikuotas Vilniaus universiteto Gyvybės mokslų centro (VU GMC) vyriausiojo mokslo darbuotojo dr. Gintauto Tamulaičio tyrimų grupės straipsnis „Ribosomal stalk-captured CARF-RelE ribonuclease inhibits translation following CRISPR signaling“ („Ribosomos stiebo surišta CARF-RelE ribonukleazė slopina transliaciją CRISPR-Cas signalizacijos metu“).
CRISPR-Cas sistemos yra vienas iš bakterijų būdų apsisaugoti nuo virusų. Bakterijose aptinkamos kelių tipų apsauginės CRISPR-Cas sistemos, kurios skiriasi Cas baltymais ir jų funkcijomis. Šiuo metu žinomiausi Cas9 ir Cas12 baltymai, dar vadinami DNR genų žirklėmis, yra plačiai pasaulyje naudojami genomo redagavimo įrankiai.
Dr. G. Tamulaičio vadovaujama mokslininkų grupė tyrinėja CRISPR-Cas10 bakterijų apsaugos nuo virusų sistemas, kurios pasižymi keliais skirtingais aktyvumais. Virusui užpuolus bakteriją, CRISPR-Cas10 sunaikina ne tik viruso DNR, kaip Cas9 ar Cas12, bet kartu sukarpo ir RNR, viruso transkriptus. 2017 m. „Science“ žurnale publikuotame straipsnyje ši komanda parodė, kad CRISPR-Cas10 antivirusinės sistemos, atpažinusios į ląstelę patekusią viruso RNR, sintetina unikalias signalines molekules – ciklinius oligoadenilatus, kurie aktyvuoja įvairius pagalbinius CARF baltymus efektorius, atpažįstančius signalą ir užtikrinančius apsaugą nuo virusų.
Nauja „Science“ publikacija yra dr. G. Tamulaičio grupės sėkmingai vykdomų mokslinių tyrimų tąsa. Joje VU mokslininkai, naudodami bioinformatinę analizę, biocheminius ir struktūrinius tyrimus, charakterizavo naują baltymų efektorių šeimą – Cami1. Mokslininkų grupė parodė, kad, virusui užpuolus bakteriją, CRISPR-Cas10 signalinės molekulės aktyvuoja Cami1 – nuo ribosomų priklausomą ribonukleazę. „Aktyvuotas Cami1 sunaikina RNR tarpininkus, dalyvaujančius baltymų sintezėje, taip slopindamas ląstelės augimą. Tai leidžia bakterijai taupyti resursus ir užkerta kelią virusui pasigaminti reikalingus baltymus“, – tyrimo rezultatus pristato dr. G. Tamulaitis.
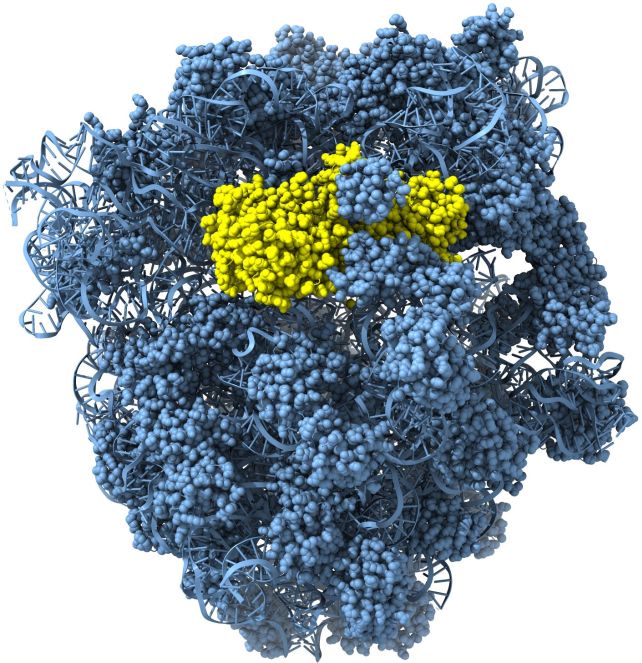
Pasitelkdami rentgeno struktūrinę analizę ir krioelektroninę mikroskopiją (cryo-EM), VU mokslininkai nustatė pavienio Cami1 ir Cami1 komplekso su baltymų sintezės aparatu – ribosoma – struktūras. Struktūriniai tyrimai leido suprasti, kaip Cami1 geba atpažinti ir kirpti tik RNR tarpininkus, dalyvaujančius baltymų sintezėje. Šie tyrimai atskleidė, kad Cami1 patekti į ribosomos baltymų sintezės centrą padeda sąveika su specializuota ribosomos stiebo struktūra. „Įdomu, kad tokį patį patekimo į ribosomas mechanizmą naudoja ir augalų antivirusiniai ribosomas inaktyvuojantys baltymai. Šis atradimas atskleidė naują viruso slopinimo mechanizmą CRISPR-Cas antivirusinėje gynybos sistemoje ir parodė bendrą antivirusinę strategiją, kuria dalijasi eukariotai ir bakterijos. Žinios apie mūsų charakterizuotus Cami1 baltymus gali būti pritaikytos biotechnologijoje ir terapijoje, kuriant naujus molekulinius įrankius“, – teigia dr. G. Tamulaitis.
Ribosomos-Cami1 kompleksui vizualizuoti buvo pasitelktas 2020 m. VU GMC įsigytas atvirosios prieigos 200kV kriotransmisijos elektroninis mikroskopas „Glacios“. Naudojant šį prietaisą gauti tyrimų rezultatai šiemet buvo publikuoti „Nature“, o dabar ir „Science“ žurnaluose.
Allochromatium vinosum Cami1 baltymo (geltona) ir Escherichia coli ribosomos (mėlyna) komplekso struktūra. I. Mogilos ir G. Tamulaitienės iliustracija
„Science“ žurnale publikuotus tyrimus atliko VU GMC mokslininkų kolektyvas: dokt. Irmantas Mogila, dr. Giedrė Tamulaitienė, magistrantas Konstanty Keda, dr. Albertas Timinskas, Audronė Rukšėnaitė, dr. Giedrius Sasnauskas, prof. Česlovas Venclovas, prof. Virginijus Šikšnys ir dr. Gintautas Tamulaitis.
„Science“ yra vienas dažniausiai cituojamų tarptautinių mokslo žurnalų, skelbiantis geriausius recenzuojamus tyrimus, apimančius visas mokslo ir technologijų sritis. „Science“ grupės žurnalus leidžia Amerikos mokslo pažangos asociacija (American Association for the Advancement of Science, AAAS), seniausia ir didžiausia mokslo organizacija pasaulyje.
Šie tyrimai buvo finansuoti Lietuvos mokslo tarybos (grantas S-MIP-22-9 dr. G. Tamulaičiui) ir Vilniaus universiteto Mokslo skatinimo fondo (grantas MSF-JM-11/2021 doktorantui I. Mogilai).


















Komentarų nėra. Būk pirmas!